近日,永利集团88304官网生命科学学院非编码RNA与癌症实验室副教授李艳利联合复旦大学附属肿瘤医院邵杨和昆明医科大学第三附属医院王绍佳课题组发现了在卵巢癌中低表达的hsa_circ_0001546通过结合14-3-3蛋白促进Tau蛋白磷酸化并诱导Tau蛋白聚集,进而促进脂质过氧化物的产生,诱导铁死亡,最终在体外和体内抑制卵巢癌转移的新机制,该工作以Tau Aggregation-Dependent Lipid Peroxide AccumulationDriven by the hsa_circ_0001546/14-3-3/CAMK2D/TauComplex Inhibits Epithelial Ovarian Cancer PeritonealMetastasis为题发表于知名期刊Advanced Science杂志(科学院分区一区,影响因子15.1)。
铁死亡是一种由铁依赖的磷脂过氧化引起的新型程序性细胞死亡,在癌症研究的早期阶段就被发现与癌症密切相关。铁死亡的两个主要分子机制包括脂质过氧化和典型的GPX4调节的铁死亡途径,而脂质过氧化物(LPOs)的积累是铁死亡的标志。目前Tau蛋白与铁死亡的关系成为了研究热点,尽管在神经退行性疾病中已经阐明了Tau和铁死亡的关系,但在癌症中仍然缺乏相关的研究。
腹腔内扩散是上皮性卵巢癌(EOC)转移的主要方式,其预后差、复发率高。环状RNA(circRNA)是来源于前体mRNA(pre-mRNA)的共价闭合的单链转录本,参与调控多种癌症的发展。本研究通过对正常卵巢组织和卵巢癌组织进行RNA-seq二代测序筛选得到差异性低表达的hsa_circ_0001546,并且与正常卵巢组织相比,hsa_circ_0001546在EOC原位灶和转移灶中低表达,说明其对EOC总生存期(OS)和无病生存期(DFS)具有良好的影响。本研究通过RNA pull-down、质谱检测和RNA结合蛋白免疫沉淀(RIP)实验发现其能够与14-3-3蛋白家族的多个成员结合。鉴于14-3-3蛋白家族成员具有高度同源性,作者进一步研究了hsa_circ_0001546与该蛋白结合的具体位点。选取结合丰度最高的蛋白成员YWHAH蛋白作为模板,结果证明hsa_circ_0001546与YWHAH蛋白的第165-186aa区域结合。进一步,利用免疫共沉淀(Co-IP)和原位邻近连接(PLA)等实验发现hsa_circ_0001546通过促进14-3-3介导的CAMK2D的招募而促进Tau蛋白磷酸化,从而使14-3-3结合的Tau蛋白从非磷酸化转变为磷酸化(Ser324),导致Tau蛋白聚集增加,从而诱导LPOs的积累并导致LPO依赖性铁死亡。在体内,用铁死亡抑制剂ferrostatin-1和Tau蛋白抑制剂TRx0237治疗可以阻断hsa_circ_0001546对EOC细胞扩散的抑制作用,引起更明显的腹膜种植转移。
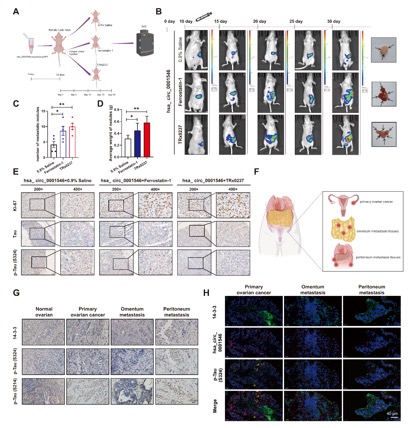
体内实验表明hsa_circ_0001546/14-3-3/CAMK2D/p-Tau复合体通过诱导Tau相关的铁死亡抑制EOC肿瘤转移
综上所述,该研究结果为hsa_circ_0001546/14-3-3/CAMK2D/Tau复合物的存在提供了新的证据,Tau蛋白聚集导致的铁死亡不仅存在于阿尔茨海默病或帕金森病等神经退行性疾病相关细胞中,还发生在EOC细胞中,并且这种由hsa_circ_0001546/14-3-3/CAMK2D/Tau复合物驱动的铁死亡是LPO依赖性的,而不是GPX4依赖性的。本研究通过一系列探索从铁死亡角度探究了hsa_circ_0001546的功能,为卵巢癌的临床诊断和靶向治疗提供新的靶标。
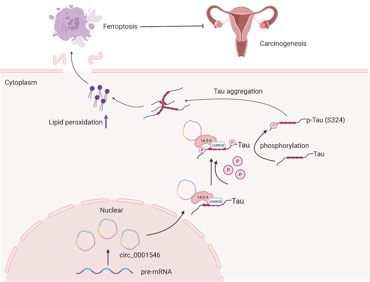
环状RNAhsa_circ_0001546抑制EOC转移的机理图
永利集团88304官网硕士研究生柴彬淑,复旦大学附属肿瘤医院主治医师吴勇和昆明医科大学第三附属医院硕士研究生杨恒慧为共同第一作者。永利集团88304官网李艳利副教授、复旦大学附属肿瘤医院邵杨助理研究员及昆明医科大学第三附属医院王绍佳副主任医师为共同通讯作者。
文章链接:https://doi.org/10.1002/advs.202310134